Een interessant artikel over de inspanningen die gedaan worden om de zeldzame ziekten te bekampen. Illustratief voor de toenemende aandacht die deze groep ziekten geniet.

Een interessant artikel over de inspanningen die gedaan worden om de zeldzame ziekten te bekampen. Illustratief voor de toenemende aandacht die deze groep ziekten geniet.

In mei kreeg Novartis de bedenkelijke eer in de V.S. het duurste medicijn ter wereld op de markt te brengen, Zolgensma met een prijskaartje van 2.1 miljoen $ (1,87 miljoen €). Een medicijn dat kinderen met SMA, een genetische en dodelijke spierziekte, zou genezen.
Het effect kan nog niet verder dan een goeie 1,5 jaar gemeten worden, zo lang duurt de trial intussen die werd opgestart bij kinderen 2 weken en 8 maanden oud. Maar de aanname is dat deze one shot therapie een blijvende inpact zou hebben. Genezing.
Echte genezing. Dat is de grote hoop die gepaard gaat met de zich in sneltempo ontwikkelende gentherapieën. Deze grijpen in op het DNA en herstellen er de ziekteverwekkende genetische fouten. Ze creëren een perspectief op genezing dat voordien ondenkbaar was voor degeneratieve en/of dodelijke aandoeningen.
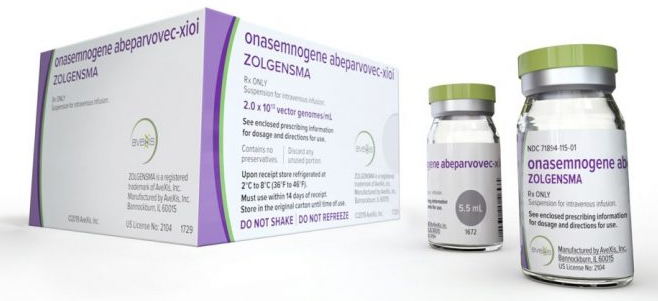
Er zitten tal van gentherapieën in de pijplijn. Daarmee ontstaat een ongekende hoop voor velen, maar tegelijkertijd dreigt er een hopeloze druk te ontstaan op de nu al exploderende kosten van de gezondheidszorg. Een argument dat de doorslag gaf om de ogenschijnlijk exuberant hoge prijs van deze therapie te aanvaarden was het volgende: de therapie vraagt om een éénmalige hoge prijs, het alternatief, Spinraza, zou heel het leven lang jaarlijks wellicht zo’n 300 000 € blijven kosten. En Spinraza moet elke vier maanden toegediend worden.
In Europa is voor Zolgensma nu de eerste stap goedkeuring door het EMA (European Medicine Agency). En dan zullen ook prijsonderhandelingen opstarten per lidstaat om het daar beschikbaar te kunnen stellen voor baby’s die hier geboren worden met SMA.
Laat ons even advocaat van de duivel spelen: wat als er volgend jaar 10 nieuwe gentherapieën op de markt moeten gebracht worden? En wat als er gentherapieën aankomen voor frequenter voorkomende aandoeningen. Niemand die nu al een plan klaar heeft om deze kansen betaalbaar te houden, maar we weten dat er aan strategieën en modellen wordt gewerkt. Hopelijk zijn we er klaar voor zijn op het moment dat deze en andere gentherapieën door EMA worden goedgekeurd. Het worden spannende tijden. Hoe zal onze toekomstige minister met deze prijsonderhandelingen omgaan? Intussen blijft de patiënt, bij gebrek aan (toegankelijke) medicatie, in het beste geval leven op hoop…
Lees de opinie van Nathan Yates, 30 jarige prof. economie en patiënt met SMA.
Andere artikels over de goedkeuring van Zolgensma, het duurste medicijn ter wereld, in The Guardian, De Tijd, Het Laatste Nieuws.
Ze zijn achter de rug, de verkiezingen. Iedereen spreekt nu over onmogelijke formatierondes die ons te wachten staan. Vanuit RaDiOrg kijken we er reikhalzend naar uit wie minister van Volksgezondheid wordt, wie aan Vlaamse zijde bevoegd zal zijn voor Zorg en Gezondheid en wie aan Franstalige kant. Dat zullen de mensen worden, met wie we vooruit willen met een belangrijk deel van ons werk: belangenverdediging voor de zeldzame ziekten op alle politieke beleidsniveaus.
Onze prioritaire focus: concentratie van expertise, multidisciplinaire consultaties voor alle mensen met een zeldzame ziekte (cfr. de MOC’s voor kanker) en casemanagers, minstens voor de meest complexe aandoeningen.
Deze maatregelen staan ingeschreven in het Belgisch Plan Zeldzame Ziekten. Ze zijn voor patiënten de belangrijkste acties in dat plan die de zorg voelbaar vooruit zullen helpen. Maar ze worden steeds afgedaan als te moeilijk, te duur, niet prioritair.
Welnu, RaDiOrg reikt oplossingen aan, wijst op de besparingen die deze verbeterde zorgkwaliteit zullen geven en we blijven benadrukken: vanuit patiëntenperspectief zijn deze maatregelen wel degelijk TOP prioriteit. RaDiOrg wil dat de levenskwaliteit verbetert voor álle mensen met een zeldzame ziekte. Zeldzaam maar talrijk. In België zijn we met 600.000. Tel daar de families en vrienden bij die de zorg mee dragen en je zit algauw aan 2 miljoen Belgen. Voor jullie allemaal willen we asap de bevoegde beleidsmakers in actie zien om onze prioriteiten te vertalen naar werkbare strategieën.
‘Mijn DNA – een zaak van iedereen?‘, met deze prikkelende stelling ging de Koning Boudewijnstichting aan de slag in een burgerforum, op vraag van de minister van Volksgezondheid. Tijdens het burgerforum werden 32 burgers uitgedaagd om aanbevelingen te formuleren voor het beleid over de vele dilemma’s die de snel evoluerende mogelijkheden van de genetica met zich mee brengen.
Voor wie moeten DNA tests ter beschikking worden gesteld? Met wie delen we de resultaten? Willen we die resultaten überhaupt zelf wel weten? In 2018 werden de dilemma’s aan de hand van 9 cases alvast ingeleid in een bevattelijke publicatie. Een aanrader! Tijdens een multistakeholder workshop op 29 maart deelde de KBS de aanbevelingen van het burgerforum met artsen, genetici, beleidsmakers en vertegenwoordigers van patiënten. Als coördinator van RaDiOrg kreeg Eva Schoeters de kans om enkele slotreflexies te formuleren. En die focusten in de eerste plaats op het onschatbare potentieel van de genetica om wetenschappelijke doorbraken te genereren voor de zeldzame aandoeningen.
Daarbij is het delen van data, véél data, over de grenzen heen essentieel. Alleen dan kan vooruitgang geboekt worden. De meeste mensen getroffen door een genetische aandoening beschouwen dit als aan vanzelfsprekendheid, op voorwaarde dat hun data natuurlijk niet in handen van verzekeraars of werkgevers komen.
Genetica vormen een essentiële tool bij de diagnostiek, ook van tot nog toe onbekende ziekten. Het identificeren van pathogene (ziekteveroorzakende) genetische fouten opent de weg naar onderzoek voor de aandoeningen in kwestie. Het verandert ze van “syndromes without a name” in geïdentificeerde ziekte, opent de weg naar onderzoek en naar de ontwikkeling van therapieën.
Maar genotypes (genetische informatie) interpreteren zonder fenotypes (klinische manifestaties) is half werk. Het genoom uitlezen is niet hetzelfde als het genoom interpreteren. Specialisatie van de expertise is aan de orde.
Het beheer van de massa aan genetische data waar we in de nabije toekomst mee geconfronteerd worden, stelt ons voor een belangrijke uitdaging. De data hebben een grote marktwaarde. Daarom moet er snél werk gemaakt worden van een betrouwbaar systeem van databeheer. Opdat de belangen in de juiste handen blijven. Niet alleen in de handen van onderzoekers en overheden. Ook patiënten eisen hierin een rol. Het gaat tenslotte om hún data ten voordele van ieders gezondheid, als de uitkomst van deze oefening optimaal is.
L’ambiance était au beau fixe au Forum for Clinical Trials de Pharma.be, ce 8 mai. La Belgique fait partie du top 3 des pays européens les plus performants en termes de délivrance de permis d’études cliniques. En 2018, pas moins de 543 demandes de nouvelles études ont en effet été introduites, soit 9 % de plus qu’en 2017. La difficulté à trouver des participants pour ces essais et à les garder jusqu’à leur terme est, cependant, un des principaux obstacles qui nuancent quelque peu cette euphorie.
Les choses se corsent évidemment encore plus pour les maladies rares. Un patient qui souffre d’une maladie rare est pourtant généralement disposé à participer à un essai. Logique : dans la plupart des cas, ces essais constituent la seule chance de trouver un médicament. Il n’en reste pas moins qu’il est relativement compliqué de trouver un nombre suffisant de participants pour les maladies rares. Les partenariats internationaux s’imposent dès lors souvent comme une nécessité.
À l’échelle internationale, les maladies rares constituent un problème de santé publique qui, selon les estimations, touche environ 350 millions de personnes. Un traitement curatif n’existe que pour 5 % des plus de 6 000 maladies rares connues, dont moins de la moitié bénéficient d’une représentation par une association de patients. De telles associations pourraient néanmoins largement contribuer à la recherche et au développement de thérapies. Dans un premier terme, en participant, à la définition des priorités pour la recherche sur la maladie qu’elles représentent (cf. le projet Mind-the-Gap ! De la Fondation Roi Baudouin), mais aussi et surtout au niveau de la détermination des critères d’efficacité pertinents d’une étude, en apportant leurs contributions au modèle de l’essai et, enfin, en trouvant et en soutenant les participants.
Les inquiétudes exprimées par rapport à la volonté de participation d’un patient atteint d’une maladie rare à des essais sont fondées : le patient sera-t-il correctement informé des objectifs précis de l’essai ? Le modèle sera-t-il suffisamment convivial pour le patient ? L’ ‘informed consent (documents à signer pour consentir à la participation) sera-t-il rédigé dans un langage suffisamment intelligible ? Qu’adviendra-t-il si le médicament s’avère efficace, mais n’est jamais commercialisé ? Le patient pourra-t-il en bénéficier à l’issue de l’essai ? Etc.
Ces inquiétudes n’atténuent néanmoins en rien l’importance de la collaboration entre les associations de patients et le secteur biopharmaceutique, de plus en plus présentée comme essentielle à la réussite des essais. À juste titre. Pour vous former en la matière, EUPATI et EURORDIS entre autres vous proposent des possibilités de formation. Car vous avez un rôle primordial à jouer, en tant qu’association de patients. Sans oublier qu’une bonne collaboration avec l’industrie biopharmaceutique présuppose un représentant des patients bien informé. Cette collaboration positive augmentera les chances d’un avenir meilleur, pour toutes les personnes atteintes de « votre » maladie.
600.000 Belgen met een zeldzame ziekte, 23 miljoen Europeanen, 350 miljoen wereldburgers. We zijn met behoorlijk wat. RaDiOrg’s missie is een optimale levenskwaliteit voor iedereen die leeft met een zeldzame ziekte. Want bij goede gezondheidszorg mag niemand uit de boot vallen! Zeldzame ziekten, dat zijn er meer dan 6.000 verschillende die iedereen willekeurig kunnen treffen, ongeacht ras, leeftijd, stand of stemgedrag. Slechts voor 5 % van die zeldzame ziekten bestaat een genezende behandeling. En zeldzame ziekten zijn niet zelden complex, ernstig invaliderend, degeneratief en levensverkortend. Dus ja, de noden liggen hoog bij deze groep stemgerechtigde patiënten en ouders.
Daarom een kleine oefening: wat staat er in de verkiezingsprogramma’s voor ons in de aanloop naar 26 mei? Bij deze ongefilterd, zonder commentaar en met verwijzing naar de bronteksten die beschikbaar waren op zondag 19/05 een overzicht van de standpunten van de Vlaamse partijen inzake gezondheidszorg. De keuze is aan ú.
Goede gezondheidszorg begint met gezond leven. Daarom investeren we éérst in preventie en eerstelijnsgezondheidszorg. Wie zorgafhankelijk is door ouderdom, ziekte of handicap heeft recht op zorg op maat. Open Vld kiest resoluut voor een financiering van mensen op basis van hun zorgbehoefte, niet voor een financiering van structuren. Deze persoonsvolgende financiering geeft mensen terug de regie over het eigen leven in handen zowel in de thuiszorg, semi-residentiële en residentiële zorg, zoals woonzorgcentra. De overheid bepaalt de spelregels en garandeert zo de kwaliteit voor iedereen. Zo stimuleren we het sociaal ondernemerschap. Om de levensstandaard van mensen maximaal op peil te houden, is de kost voor verzorging in principe ten laste van de overheid. We investeren opnieuw fors in het wegwerken van: wachtlijsten voor personen met een handicap. Lees meer >
Een gezond leven is en blijft de basis van een goede levenskwaliteit. Maar een goede gezondheidszorg wacht niet tot we ziek zijn. Ziekte voorkomen én goed zorg dragen voor jezelf en elkaar zijn minstens zo belangrijk. Een gezond leven is en blijft de basis van een goede levenskwaliteit en blijft voor ons de grootste prioriteit. Lees meer>
Onze bevolking veroudert snel. Minder mensen dragen bij aan het systeem, terwijl de groep mensen die meer zorgen nodig heeft, groeit. Doen we niets, dan wordt de factuur binnenkort onbetaalbaar. En dan verliezen we allemaal. Lees meer >
Als je je arm breekt, krijg je op spoed meteen een gips. We vinden dat maar normaal. Maar als je een handicap hebt, moet je jaren wachten op je centen voor de juiste zorg. Als je kind acute psychologische zorg nodig heeft, dan moet je maanden wachten op de gepaste zorg. Wij vinden dat niet normaal. Daarbovenop stellen heel wat Vlamingen een bezoek aan de huisarts, psycholoog of tandarts uit wegens financiële redenen. Wij vinden dat niet normaal. Vlaanderen beleeft een zorgcrisis en daarom grijpen wij in. Het is tijd om opnieuw te zorgen voor zorgzekerheid. Voor iedereen. Lees meer >
✓ Het Vlaams Belang wil de volledige splitsing van de Belgische sociale zekerheid.
✓ Een eigen Vlaamse sociale zekerheid op maat van de Vlamingen.
✓ Wij willen de bestaande gekleurde ziekenfondsen fuseren tot één neutraal ziekenfonds voor een gestandaardiseerde wettelijke ziekteverzekering.
✓ Het uitbetalen van sociale tegemoetkomingen die voor iedereen gelijk zijn, zoals medische kosten of werkloosheidsuitkeringen, moet een exclusieve taak voor de overheid zijn.
✓ Geen verdere verhoging van de niet-inkomensgerelateerde Vlaamse zorgpremie. De financiering van de uitkeringen voor onze zorgbehoevenden moet uit de algemene middelen worden gefinancierd. Lees meer >
Genoeg gewacht. Elke persoon met een handicap krijgt een zorgbudget op maat. Niet na tien jaar wachten, maar nu. Goede zorg is voor iedereen verschillend. Thuis of in een voorziening? Wel of niet met een persoonlijke assistent? Een persoonsgebonden budget geeft je de vrijheid om zelf je ondersteuning te kiezen. We zorgen ook voor voldoende plaatsen in de jeugdhulp, de geestelijke gezondheidszorg en de ouderenzorg.
Want een wachtlijst helpt niemand vooruit. We leven in een welvarend land, we kunnen zorgen voor iedereen die daar nood aan heeft. Zoals het er nu aan toegaat, kan het echt niet langer. Kinderen en jongeren moeten gemiddeld vier jaar wachten op een persoonlijk assistentiebudget. Bijna 7000 minderjarigen wachten op jeugdhulp. En 21.000 jongeren met een ernstige psychiatrische aandoening missen de deskundige hulp die ze nodig hebben.
Zorg is geen bandwerk maar handwerk. Voor rusthuizen trekken we de personeelsnormen op. In de thuiszorg voorzien we minder uren in de auto en meer bij de patiënt. Onze zorgverleners zijn erg gemotiveerd en goed opgeleid, maar ze zijn simpelweg met te weinig. We geven hen de ruimte om meer met mensen bezig te zijn dan met de klok. Lees meer >
De gemeenschap moet instaan voor de gezondheidszorg. Ze moet daar voldoende financiële middelen voor hebben. We zetten de markt buitenspel en investeren in een publieke gezondheidszorg van kwaliteit en op mensenmaat. Gezondheid is geen markt, maar een basisrecht voor iedereen. We gaan voor de uitbouw van sociale groepspraktijken waar je gratis naar de dokter kan en we versterken hun aanbod met sociaal werkers en psychologen. Met het kiwimodel kraken we de prijs van geneesmiddelen. We verlagen ook de prijs voor specialisten en voor een ziekenhuisopname. Lees meer >
